バリデーション
バリデーション
GMPに基づいたバリデーションで、実践的なサービスを提供します。
医薬品は人の健康や生命に直接関係する製品であることから、製造過程から最終製品まで徹底した品質管理が必要とされています。厚生労働省GMP省令等では、有効性と安全性を確保した高品質な医薬品を製造するためにバリデーション(製造管理及び品質管理方法の適正検証)の実施が要求されています。当社の製造・生産管理システムはシステムインテグレーションにおいて、バリデーションに対応したサービスを提供しています。
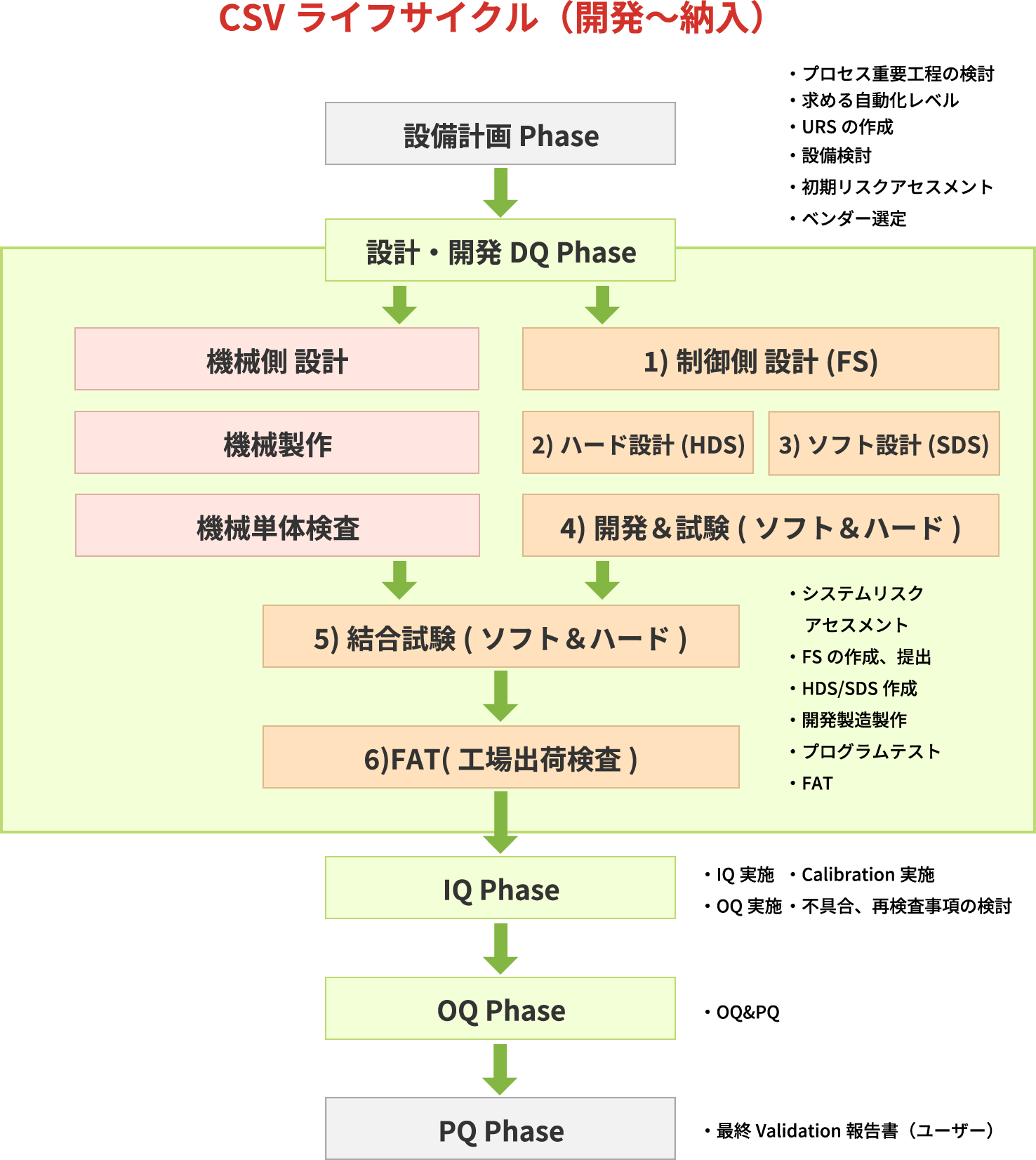
CSV(コンピュータ化システムバリデーション)のコンサルタントを始め、DQ(設計時適格性評価)・IQ(据付時適格性評価)・OQ(運転時適格性評価)関連業務及び運用サポート、キャリブレーションSOP(標準作業手順書)作成等、幅広くお客様の要求にお応えしています。
設備の新規導入や更新において、ご要望に沿った様々なプランをご提案いたします。
バリデーションへの取組み
日本でGMPが制定されたと同時にバリデーションを取組み、40年以上に亘り原薬、治験薬、製剤関連設備・装置等各製造設備におけるバリデーション業務に従事しております。
| 1980年 | 国際製薬技術協会(ISPE)設立時加盟 |
|---|---|
| 1983年 | 某社ビタミン合成設備制御システムを受注 医薬分野進出の先駆けとなる |
| 1987年 | 製剤工場コーティング設備システム構築 |
| 1990年 | 製剤機械自動化&ネットワークシステム構築 |
| 1992年 | 「コンピュータ適正管理マニュアル」策定委員会に参画(旧厚生省) |
| 1994年 | バリデーション関連セミナー受講 米GMPコンサルティングKemper Masterson社(以降KMI社)にて受講 |
| 1995年 | Rockwell社&KMI社&三興コンピューターソフトウエアにより東京でバリデーションラウンドテーブル開催 製薬会社、製薬機械メーカ、エンジニアリング会社等 (KMI社:現PAREXEL International社) |
| 1997-1998年 | 米国医薬品工場 VEプラント設備 制御関連のコンサルタントに従事 |
| 2001年 | 21 CFR Part11関連意見交換会参加(米国) Rockwell社、Brock Solution社(米国)等参加 |
| 2003年 | 21 CFR Part11関連意見交換会参加(米国) Rockwell社、Brock Solution社(米国)等参加 |
CSV適格性確認の実施内容
コンピュータ化システム適正管理ガイドラインに準拠した業務のうち、主体サービスとしているDQ・IQ・OQの内容になります。
DQ 設計時適格性評価業務

- URS(ユーザー要求仕様書)作成支援
- リスクアセスメント実施
- FS(機能仕様書)作成
- DS(設計仕様書)作成
システムテスト,FAT,SAT

IQ据付時適格性評価業務

- IQ実施(ユーザー工場作業)
OQ運転時適格性評価業務

- 計画書作成
- OQ実施(ユーザー工場作業)
他サポート業務
開発計画作成サポート/PQ(性能適格性評価)サポート/システム運用管理業務サポート/システムリタイヤメント計画作成サポート